Die Arbeitsgruppe Molekulare Onkologie wurde 1991 gegründet und bearbeitet verschiedene Forschungsbereiche der gynäkologischen Onkologie auf molekularer Ebene.
Die Hauptziele sind ein besseres Verständnis der Tumorbiologie, Biomarker für frühzeitige Diagnose und präzisere Prognosestellung beim gynäkologischen Malignom zu identifizieren und zu validieren und darauf basierend neue Therapiekonzepte zum Vorteil der Patientinnen zu entwickeln.
Aktuelle Projekte sind die Detektion und molekulare Charakterisierung disseminierter Tumorzellen, die Identifizierung und Validierung von Biomarkersignaturen für die frühzeitige Diagnose und die Charakterisierung von Rezidiven.
Die interdisziplinäre Arbeitsgruppe ist in nationalen und internationalen Institutionen und Netzwerken aktiv (z.B. TOC – Tumor Bank Ovarian Cancer; EUTROC – European Network for Translational Research in Ovarian Cancer; OVCAD – Ovarian Cancer Diagnosis; Ludwig Boltzmann Gesellschaft – Cluster Translational Oncology).

Ao. Univ.-Prof. Dr. Robert Zeillinger
LeiterTel.: +43 (0)1 40400-78310
E-Mail: robert.zeillinger@meduniwien.ac.at
Die Gruppe mit dem Fokus auf Eierstockkrebsforschung wurde 2016 gegründet. Das Hauptinteresse liegt darin, die zugrundeliegenden molekularen Mechanismen von Chemoresistenz und unkontrollierbarer Zellproliferation von Tumorzellen, sowie die Mikroumgebung des Tumors und möglicher therapeutischer Zielmoleküle zu erforschen.
In den letzten Jahren hat die Gruppe 40 Zelllinien aus Tumorproben von Patientinnen etabliert und damit neue Modelle für Forschung und Therapieentwicklung geschaffen. Im Rahmen eines internationalen Kollaborationsprojekts (OCTIPS: www.octips.eu) wurden gepaarte Primär- und Rezidivtumore von Patientinnen gesammelt und neue Kenntnisse über das Wiederauftreten von Tumoren gewonnen. Das Labor ist sehr erfahren in molekularbiologischen und zellbiologischen Technologien.
Die Gruppenleiterin ist Koordinatorin eines FP7 EU-Projekts mit zehn internationalen Partnern (OCTIPS: Ovarian Cancer Therapy – Innovative Models Prolong Survival).
Kreuzinger C, Geroldinger A, Smeets D, Braicu EI, Sehouli J, Koller J, Wolf A, Darb-Esfahani S, Joehrens K, Vergote I, Vanderstichele A, Boeckx B, Lambrechts D, Gabra H, Wisman GBA, Trillsch F, Heinze G, Horvat R, Polterauer S, Berns E, Theillet C, Cacsire Castillo-Tong D.
A Complex Network of Tumor Microenvironment in Human High-Grade Serous Ovarian Cancer.
Clin Cancer Res. 23:7621-7632, 2017. IF: 9.619
Michael Kenn, Karin Schlangen, Dan Cacsire Castillo-Tong, Christian F. Singer, Michael Cibena, Heinz Koelbl and Wolfgang Schreiner.
Gene expression information improves reliability of receptor status in breast cancer patients.
Oncotarget. 8:77341-77359, 2017. IF: 5.168
Ruscito I, Cacsire Castillo-Tong D, Vergote I, Ignat I, Stanske M, Vanderstichele A, Ganapathi RN, Glajzer J, Kulbe H, Trillsch F, Mustea A, Kreuzinger C, Benedetti Panici P, Gourley C, Gabra H, Kessler M, Sehouli J, Darb-Esfahani S, Braicu EI.
Exploring the clonal evolution of CD133/aldehyde-dehydrogenase-1 (ALDH1)-positive cancer stem-like cells from primary to recurrent high-grade serous ovarian cancer (HGSOC). A study of the Ovarian Cancer Therapy-Innovative Models Prolong Survival (OCTIPS) Consortium.
Eur J Cancer. 79:214-225, 2017. IF: 6.029
Flanagan JM, Wilson A, Koo C, Masrour N, Gallon J, Loomis E, Flower K, Wilhelm-Benartzi C, Hergovich A, Cunnea P, Gabra H, Braicu EI, Sehouli J, Darb-Esfahani S, Vanderstichele A, Vergote I, Kreuzinger C, Cacsire Castillo-Tong D, Wisman GB, Berns EM, Siddiqui N, Paul J, Brown R.
Platinum-based chemotherapy induces methylation changes in blood DNA associated with overall survival in ovarian cancer patients.
Clin Cancer Res. 23:2213-2222, 2017. IF: 9.619
Kreuzinger C, Gamperl M, Wolf A, Heinze G, Geroldinger A, Lambrechts D, Boeckx B, Smeets D, Horvat R, Aust S, Hamilton G, Zeillinger R, Cacsire Castillo-Tong D.
Molecular characterization of 7 new established cell lines from high grade serous ovarian cancer.
Cancer Lett. 362:218-28, 2015. IF: 6.375
Unsere Arbeitsgruppe fokussiert auf erbliche Krebserkrankungen, insbesondere BRCA1/2 und verwandte Krebsprädispositionsgene. Wir verbinden zwei eng vernetzte Schwerpunkte: die klinische Versorgung (genetische Beratung, Diagnostik und Betreuung) sowie die klinische und translationale Forschung. Ziel ist es, genetische, klinische, tumor- und lebensstilbezogene, und patientenberichtete Daten zu integrieren, um Risikoabschätzung, Prävention und langfristige Versorgungsstrategien zu verbessern.
Die Gruppe ist in internationale Forschungsverbünde wie CIMBA, ENIGMA, BCAC, IBCCS und CONFLUENCE eingebunden und beteiligt sich an strukturierter PhD-Ausbildung und internationaler Mobilität im Rahmen des EU MSCA Doctoral Network.
Weitere Informationen zu unserem Forschungsprogramm und aktuellen Forschungsmöglichkeiten: yen.tan@meduniwien.ac.at
Weitere Informationen zur genetischen Beratung und klinischen Versorgung:
Die Ursache und der Verlauf der Endometriose sind in vielen Aspekten noch nicht vollständig geklärt. Es ist uns daher ein Anliegen, im Interesse der betroffenen Frauen nicht nur in Diagnostik und Therapie modernste Konzepte anzubieten, sondern uns auch den noch offenen Fragen auf wissenschaftlichem Weg zu nähern.
An unserem Zentrum finden laufend zahlreiche klinische Studien statt. Unter anderem beschäftigen sich diese Arbeiten mit den Schwerpunkten:
- Suche nach einem nicht-invasiven Diagnostikmarker für Endometriose
- Rolle von Neugefäßbildung (Angiogenese)
- Entwicklung neuer und nebenwirkungsärmerer Therapiekonzepte
- Die Rolle ernährungsmedizinischer Maßnahmen auf den Schmerzverlauf bei Endometriosepatientinnen
Alle Studien werden nach strengsten ethischen und medizinischen Kriterien durchgeführt. Nach Prüfung und Freigabe durch die Ethikkommission der Medizinischen Universität Wien werden diese nach den Kriterien der Deklaration von Helsinki und good clinical practice (GCP) durchgeführt. Selbstverständlich ist die Teilnahme an diesen Studien völlig freiwillig und kann jederzeit widerrufen werden.
Team
Univ.-Prof. Dr. Alexander Reinthaller
Prüfärzt:innen
Assoc.-Prof. Priv.-Doz. Dr. Christoph Grimm
Assoc.-Prof. Priv.-Doz. Dr. Stephan Polterauer
Assoc.-Prof.in Priv.-Doz.in Dr.in Veronika Seebacher-Shariat
Änderungen von Versorgungsprozessen und Versorgungsstrukturen führten in den letzten Jahren dazu, dass Medizin vor allem in spezialisierten Zentren unter Zugrundelegung von Leitlinien-gestützter Versorgung, Qualitätsmanagement und unter Anwendung von Disease-Management-Programmen und entsprechendem Krisenmanagement praktiziert wird. Vorrangiges Ziel der Zentralisierung ist dabei eine Verbesserung der Versorgungsqualität bei gleichzeitiger Kostenreduktion. Das Feld der personalisierten Krebstherapie zielt auf Therapien ab, die sich an den einzigartigen genetischen Merkmalen des Tumors orientieren.
Die Entwicklungskosten solcher nebenwirkungsärmerer Zytotherapeutika sind enorm und die gesetzlichen Bestimmungen zur Neuzulassung dieser hochwirksamen Medikamente streng geregelt. So muss jedes Therapeutikum drei unterschiedliche Studienphasen durchlaufen, bevor es generell als Therapie zugelassen werden kann.
Im Vergleich zu vor zehn Jahren sind Studien heute aufwendiger, qualitativ hochwertiger und erheblich teurer in der Durchführung. Es braucht funktionierende Strukturen und eine starke Führung, um die protokollgemässe Durchführung der klinischen Studien zu gewährleisten und Tendenzen wesentlicher Faktoren – positiv oder negativ – zu erkennen.
Unsere Patient:innen aber versetzt die Diagnose eines Tumors oder eines Rezidivs verständlicherweise in eine emotionale Achterbahnfahrt. Mitten in der Talfahrt, lebenswichtige Entscheidungen zu treffen, ist schwierig genug, dennoch stellt sich ihnen gerade zu diesem Zeitpunkt auch die Frage der Teilnahme an einer klinischen Studie.
Insbesonders wichtig ist es uns dabei, die Patientinnen in Therapieentscheidungen mit einzubeziehen und damit die Compliance zu steigern. Die Erfahrung der letzten Jahre zeigt, dass wir durch die intensive Aufklärung vor Beginn einer Studie, sowie durch die ständige Betreuung (Erhebung der Lebensqualität und der subjektiv und objektiv empfundenen Beschwerden) während der Untersuchungsphase eine besondere Vertrauensstellung einnehmen. Zwei Drittel jener Personen, bei denen heute eine Krebserkrankung diagnostiziert wird, werden mindestens fünf Jahre nach der Diagnose noch am Leben sein.
Im Rahmen der Betreuung der Studienpatientinnen kommt es uns besonders auf die Lebensqualität an. Oft ist besonders wichtig, den Patientinnen klar zu machen, dass die Zeit in ihrer Qualität etwas Unwiederbringliches ist – was heißt, dass es manchmal notwendig ist, den Patientinnen – in der Rezidivphase – Studien anzubieten, die vor allem der Verbesserung der Lebensqualität dienen. In der Palliativsituation, mit der wir hier nur allzu oft konfrontiert werden, sollte also in erster Linie die Lebensqualität ein entscheidender Therapiebewertungsmaßstab sein.
Im Rahmen unserer Tätigkeit ist es primäres Zielkriterium, in der klinischen Routineversorgung neben dem Zielfaktor der längeren Überlebenszeit die Lebensqualität als die Möglichkeit anzusehen, die Betreuungsbedürfnisse unserer Patientinnen zu identifizieren, um dadurch eine patientinnenzentrierte Medizin realisieren zu können.
Die Klinische Abteilung für Allgemeine Gynäkologie und Gynäkologische Onkologie ist eine Einrichtung der Medizinischen Universität Wien, die im Allgemeinen Krankenhaus, dem größten Spital Österreichs beheimatet ist. Die Abteilung ist aus der Klinik Ernst Wertheims hervorgegangen und beschäftigt sich seit ihrem Bestehen auch mit der wissenschaftlichen Erforschung und klinischen Behandlung von weiblichen Beckenbodenproblemen.
Ein erfahrenes Team aus Expert:innen für den Bereich Urogynäkologie steht zur Verfügung, um die medizinische Versorgung, Forschung und Öffentlichkeitsarbeit auch auf diesem Gebiet voranzutreiben.
Projekte zu Kontinenz und Beckenboden
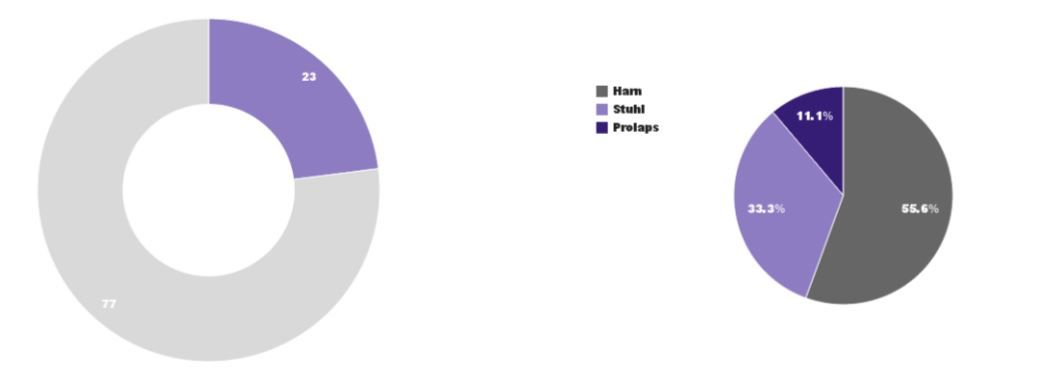
Kontinenz- und Beckenbodenprobleme zählen bei Frauen mit ca. 23% zu den häufigsten Krankheitsursachen. Die Beeinträchtigung der Lebensqualität, die dadurch ausgelöst wird, ist beträchtlich, auch wenn es sich dabei um keine gefährlichen Zustände handelt.
Da über Themen wie Inkontinenz lieber geschwiegen wird, ist es nicht leicht, die nötige Aufmerksamkeit zu erregen, um die Mittel für die ständige Verbesserung der medizinischen Versorgung Betroffener bereitzustellen.
Die Klinische Abteilung für Allgemeine Gynäkologie und Gynäkologische Onkologie ist eine Einrichtung der Medizinischen Universität Wien, die im Allgemeinen Krankenhaus, dem größten Spital Österreichs beheimatet ist. Die Abteilung ist aus der Klinik Ernst Wertheims hervorgegangen und beschäftigt sich seit ihrem Bestehen auch mit der wissenschaftlichen Erforschung und klinischen Behandlung von weiblichen Beckenbodenproblemen.
Ein erfahrenes Team aus Expert:innen für den Bereich Urogynäkologie steht zur Verfügung, um die medizinische Versorgung, Forschung und Öffentlichkeitsarbeit auch auf diesem Gebiet voranzutreiben.
Für die Bewerbung um finanzielle Unterstützung nominierte Projekte
Grundlagenforschung:
Endokrine Beeinflussbarkeit des Beckenbodenstützgewebes durch Hormonrezeptoren.
Dietrich, Elenskaia, Umek, Hanzal
3-D printing of anatomic structures using the Makerbot replicator 2.
Hanzal, Kölbl
Beckenbodendysfuktion bei Radfahrerinnen
Umek
MR Spectroscopy of the female continence mechanism
Umek, Kölbl
Diagnostik:
3-D Ultraschalldiagnostik des Beckenbodens
Laterza
Entwicklung einer Miktionstabelle als Smartphone-App
Hanzal
Konservative Therapie:
Pessartherapie vs. watchful waiting bei Beckenorganprolaps
Hanzal
Medizinprodukte:
Feasibility-Fallserien bei neuartigen Netzimplantaten (z.B. Artisyn)
Hanzal, Umek, Kölbl
Arzneimittel:
Vitamin D vs. Placebo bei Overactive Bladder Syndrome
Häusler
Solifenacin bei OABS nach synthetischen midurethralen Schlingen
Laterza, Kölbl
Operative Urogynäkologie:
Laparoskopische Sakrokolpopexie vs. Vaginaefixatio sacrospinalis. eine randomisierte Multicenterstudie
Laterza, Kölbl
Urogynäkologische Operationen iRd Surgical Skills Training Center
Umek, Hanzal
Evidence-based Practice:
Systematischer Review: operative Therapie des Urethraldivertikels
Elenskaia, Bodner-Adler, Hanzal
Systematischer Review: operative Therapie von post-Hysterektomie Vesikovaginalfisteln
Bodner-Adler, Elenskaia, Hanzal
Öffentlichkeitsarbeit:
Regelmäßige Zuweiserveranstaltung (1x/Jahr)
alle
Laienveranstaltung Kontinenz und Beckenboden (1x/Jahr)
alle
Klinische Wissenschaft für Laien
Hanzal
Das Ziel des CCC-GCU ist die bestmögliche Betreuung und Behandlung von Frauen mit einer gynäkologischen Krebserkrankung.
Durch optimale Vernetzung, Nutzungen von Synergien und gemeinsame Innovation aller am CCC-GCU beteiligten Disziplinen versuchen wir, die optimalen Rahmenbedingungen für die Eckpfeiler Patiententinnenversorgung, Lehre und Wissenschaft zu schaffen.
Das „Surgical Skills Training Center“ (SSTC) an der Universitätsklinik für Frauenheilkunde der MedUni Wien wurde im Jänner 2010 gegründet. Das Trainingszentrum ist eine moderne Ausbildungseinrichtung, die das ideale Umfeld für die theoretische und praktische Schulung von grundlegenden bis fortgeschrittenen, chirurgischen Fertigkeiten bietet. Die dafür nötige Infrastruktur steht in Form eines „Dry Labs“ zur Verfügung.
Das SSTC ist eine rein akademische Institution, die verschiedene Curricula für Ärzt:innen und Studierende der MedUni Wien anbietet und ein strukturiertes, organisiertes Training von chirurgischen Fertigkeiten – mit dem Schwerpunkt Laparoskopie – unter laufender Evaluierung durchführt. Des Weiteren werden im Zuge des chirurgischen Trainings klinische Studien und Maßnahmen zur Qualitätssicherung durchgeführt.
E-Mail: sstcmuv@gmail.com
Die Hashimoto-Thyreoiditis ist eine Autoimmunentzündung der Schilddrüse und eine der häufigsten Erkrankungen von endokrinen Organen bei Frauen. Hier wird ein immunologischer Zusammenhang mit dem POF (= Premature Ovarian Failure) immer klarer.
Das klimakterische Syndrom bildet nicht zuletzt durch die Verstärkung unseres Teams durch Prof. Dr. Markus Metka einen weiteren wichtigen Schwerpunkt der Hormonambulanz, so wurde auch mit Frau Priv.-Doz.in Dr.in Dana Muin MMSc, MRes folgende Studie begonnen:
„Eine monozentrische, doppel-blind randomisierte placebo-kontrollierte Studie über den Einfluss von synthetischem Isoflavon S-Euqol, isoflavonreichen Naturprodukten (Sojamilch) und Hormonersatztherapie (Femoston mite) auf humane Darmbakterien in 120 postmenopausalen Patientinnen an der Universitätsklinik für Frauenheilkunde in Wien.“
Ein besonderes Thema bildete auch die Diskussion rund um die Kontrazeption und das Thromboserisiko, wobei es hier durch Meldungen in den Medien zu einer Verunsicherung der Patientinnen kam. Sorgfältige Anamnese und Aufklärung konnten hier Abhilfe schaffen und die richtige, weil individuelle Kontrazeptionsform finden.
Das von der EU im 7. Rahmenprogramm geförderte Forschungsprojekt HYPERLAB (High Yield and Performance Stem Cell Lab) wurde im September 2009 gestartet. Der Schwerpunkt dieses Projektes liegt auf der Optimierung von gegenwärtigen Stammzell-Kultivierungsmethoden. Innovative neue Techniken (Pipet Robots, Pipe-Based Bioreactors) werden an die besonderen Anforderungen der Stammzell-Kultivierung adaptiert und sollen so den Arbeitsaufwand für die Kultivierung reduzieren, sowie ein High-Throughput-Screening von unterschiedlichen Medien und Wachstumsfaktoren ermöglichen.
An der Universitätsklinik für Frauenheilkunde werden in Zusammenarbeit mit den Projektpartnern Protokolle zur Expansion und Differenzierung von CD34-positiven hämatopoietischen Stammzellen aus Nabelschnurblut etabliert und optimiert.
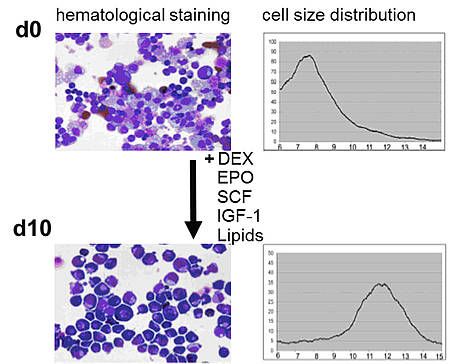
Glucocorticoide werden in der Klinik häufig zur Behandlung von sogenannten aplastischen Anämien eingesetzt. Als Wirkungsmechanismus wird meist die Immunsuppression angenommen, die zu einer Normalisierung der Blutbildung beiträgt. Neuere Forschungsergebnisse zeigen aber, dass Glucocorticoide in vitro direkt auf erythroide Zellen wirken, deren Proliferation anregen und die terminale Differenzierung hemmen. Bei der Analyse der Auswirkungen des Glucocorticoides Dexamethason auf die Genexpression von erythroiden Vorläuferzellen der Maus wurden Gene identifiziert, die entweder nur durch Dexamethason reguliert werden oder die komplexer Regulation durch die Kombination der Wachstumsfaktoren Erythropoietin und Stem Cell Factor (SCF) mit Dexamethason unterliegen (A. Kolbus, M. vonLindern, H. Beug, unpublished data).
In Pilotstudien konnte für eine Auswahl dieser Gene gezeigt werden, dass sie in humanen erythroiden Zellen aus Nabelschnurblut gleichartig reguliert werden wie in den Maus-Zellen. Im Rahmen der Diplomarbeit von Michela Parth wurde die Bedeutung einer ersten Auswahl dieser Dexamethason-regulierten Gene durch siRNA-vermittelten knock-down untersucht. Zur Transfektion der Primärzellen wurde die Elektroporationsmethode verwendet. Knock-down von zwei Glucocorticoid-regulierten Genen führte zu vermehrter Apoptose. Die Signaltransduktionsmechanismen, die für die Zunahme des programmierten Zelltodes verantwortlich sind, werden derzeit untersucht.
Aus dem Mausmodell ist bekannt, dass die Kinase raf-1 die Balance zwischen Proliferation und Differenzierung von erythroiden Vorläuferzellen reguliert. Eine analoge Funktion in humanen Zellen wird deshalb vorausgesetzt, Daten dazu sind allerdings noch nicht vorhanden. Die Entwicklung eines erythroiden Primärkultursystems aus Nabelschnurblut in Kombination mit einer kürzlich etablierten, effizienten viralen Transduktionsmethode ermöglicht uns, die Funktion von raf-1 in humanen Zellen zu analysieren.
Erste Ergebnisse für den knock-down von raf-1 in primären, humanen Erythroblasten zeigen einen ähnlichen Phänotyp zur raf-1 knock-out-Maus. Die etablierten Methoden zur Herstellung von shRNA-Vektoren, zur Produktion, Konzentrierung und Titerbestimmung der Lentiviren sollen in weiterer Folge auch für andere Gene, die in der Erythropoiese eine Rolle spielen, angewandt werden. Als Ergänzung zu den oben beschriebenen viralen Transduktionsmethoden steht seit kurzer Zeit auch die Methode der siRNA-Elektroporation zur Verfügung.
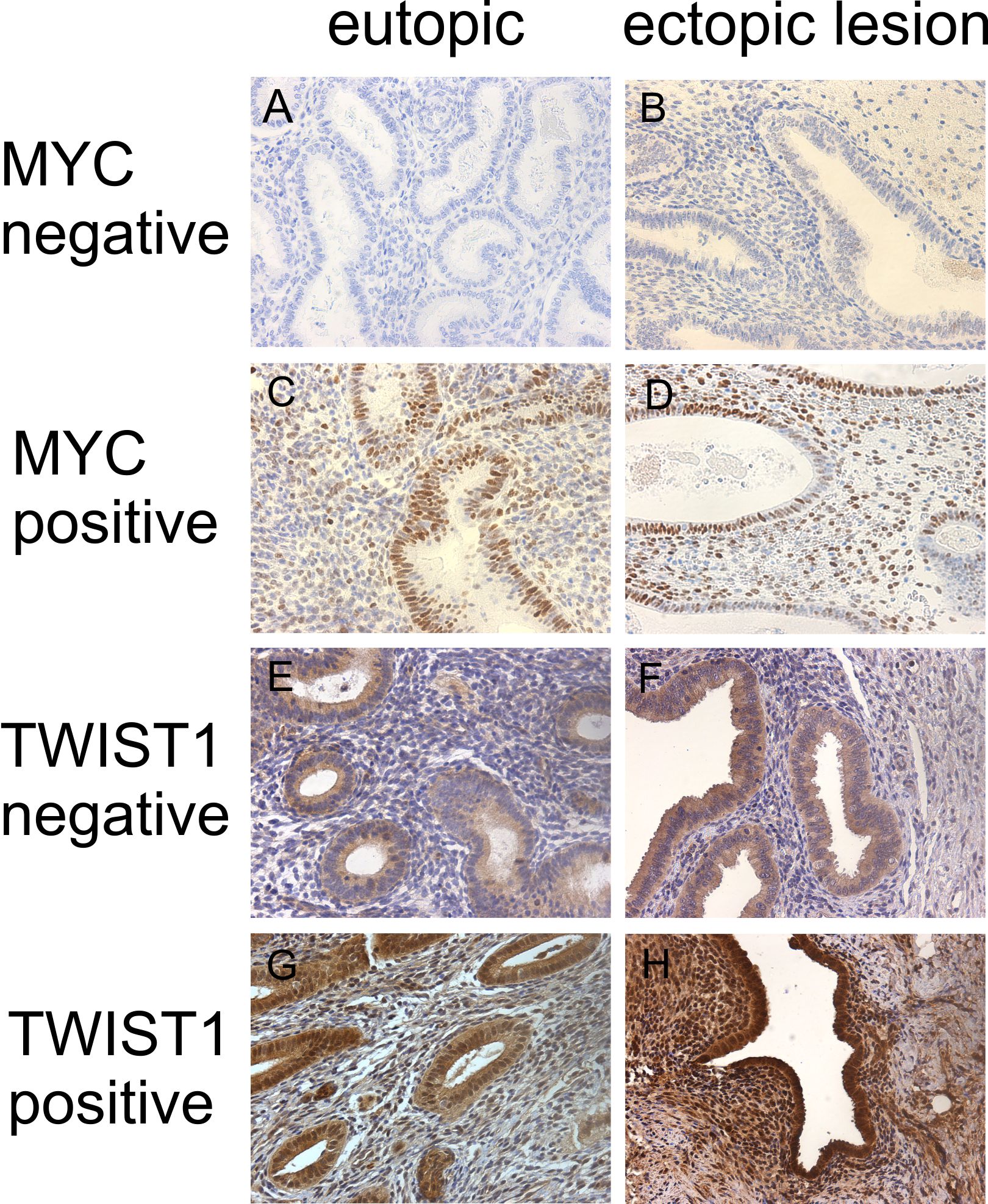
Endometriosis is a common benign estrogen dependent chronic gynecological disorder associated with pelvic pain and infertility. It is characterized by the presence of uterine endometrial tissue outside of normal environment. The prevalence of pelvic endometriosis approaches 6-10% of general female population in the reproductive age. How uterine endometrial tissue following retrograde menstruation is able to migrate towards and to invade extrauterine sites is presently unclear. However, signalling pathways involved in regulation of proliferation and migration can be differentially regulated in ectopic lesions and eutiopic endometrium from patients with endometriosis, compared to the control healthy population. As a model system we use primary cultures of stromal-epithelial cells obtained from tissue samples isolated from healthy women and patients with endometriosis from eutopic sites (uterus) and ectopic lesions (ovary).
The project aims to investigate the molecular mechanisms involved in the establishment of endometriosis and in particular:
- Regulation of cell migration and the role of Raf-1/ROCKII signalling pathway
- To analyze the role of MAPK pathway, as regulator of cell proliferation in endometriosis
- To investigate the role of Raf-1/ROCKII signalling pathway in regulation of cell proliferation in our in vitro cell system
The aim of the project is to clarify the function of the non-genomic estrogen action in pathogenesis of endometriosis. In particular our goal is:
- To identify signal transduction pathways regulated by fast estrogen receptors-mediated signals
- To specify estrogen receptors subtypes (classical and non-classical) involved in this regulations.
- To provide the molecular mechanisms involved in the non-genomic estrogen action.
Angiogenesis, the production of new blood vessels from pre-existing endothelium is subject to a complex control system with proangiogenic and antiangiogenic factors. This process is an important factor in several pathological processes such as tumor growth, diabetic retinopathy, psoriasis as well as endometriosis.
Our project aims to investigate, whether endothelial aromatase is an autocrine inducer of human utherine microvascular endothelial cell proliferation. HUMEC as model for small vessels to compare basal and testosterone stimulated expression of aromatase, local estradiol production and to reveal its potential implications on cell proliferation are used. In addition to the testosterone associated autocrine estradiol production and action in vascular cells, testosterone may directly take place in the regulation of microvacularization via its cognate receptor. However, no information is available about testosterone effects on HUMEC from female reproductive tract. Therefore, we will examine the direct effects of the hormone on HUMEC cell proliferation.
Endometriose ist eine häufige gynäkologische Erkrankung, welche 6–10% der Frauen im gebärfähigen Alter betrifft. Sowohl das eutopische Endometrium von Frauen mit Endometriose als auch das endometriotische Gewebe selbst unterscheidet sich in verschiedenen Aspekten vom Endometrium gesunder Frauen. Wir untersuchen mittels eines In-vitro-Zellsystems die molekularen Veränderungen von eutopem und ektopem Endometrium im Vergleich zu gesundem Kontrollgewebe anhand von humanen endometrialen stromalen Zellen (hESC) in der proliferativen Phase des Menstruationszyklus (Proteinexpressionslevel und funktionale Konsequenzen wie Migration, Proliferation, Adhäsion und Invasion).
Unsere Arbeitsgruppe konnte bereits zeigen, dass die erhöhte Zellproliferation und Migration in eutopen Zellen von Patientinnen mit Endometriose (Eu-hESC) verglichen mit gesunden Kontrollen (Co-hESC) durch eine vermehrte Aktivierung der Ras/Raf/MAPK- und RhoA/ROCKII-Signalwege verursacht wird. Dies ist begleitet von einer verstärkten p27kip1-Expression in Eu-hESC verglichen mit den Kontrollen.
Angesichts der Regulation zellulärer Prozesse, wie Zellmigration und -proliferation durch p27kip1, beabsichtigen wir, die zugrundeliegenden molekularen Mechanismen in Eu-, Co- und Ec-hESC zu untersuchen. Zusätzlich sollen anhand von Gewebeproben von eutopem, ektopem und Kontrollendometrium mittels Immunofluoreszenzfärbung in der proliferativen und sekretorischen Zyklusphase die Expressionslevel und subzelluläre Lokalisation von p27kip1 untersucht werden.
Zusammenfassend wollen wir die von p27kip1 regulierten Vorgänge bei Patientinnen mit Endometriose untersuchen und weiters wertvolle Informationen bezüglich seiner potentiell onkogenen Funktion im menschlichen Endometrium liefern.
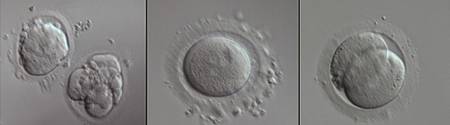
In dem von der EU geförderten Projekt Prot-HISPRA werden Faktoren untersucht, die von Oozyten und sich entwickelnden Embryonen sezerniert werden und als Marker in der klinischen Routine geeignet sind, um die Implantationswahrscheinlichkeit von Embryonen besser voraussagen zu können, als es mit bisherigen morphologischen Bestimmungen möglich ist. Dazu werden in den Kultivierungsmedien, in denen Embryonen im Rahmen einer IVF-Therapie kultiviert werden, die sezernierten Proteine sowohl quantitativ als auch qualitativ erfasst mit Hilfe von Proteomics-Techniken.
Dieses Proteinprofil wird mit den bisher genutzten morphologischen Kriterien der Embryonenbeurteilung abgeglichen. Auf diese Weise lassen sich Markerproteine definieren, die mit den morphologischen Kriterien übereinstimmen, aber auch Markerproteine festlegen, die Kennzeichen einer schlechten Morphologie sind. Anhand dieser Markerproteine lässt sich dann ein neues Qualitätsmaß für Embryonenqualität entwickeln. Ein wesentlicher Teil des Projekts besteht in der Entwicklung von Hochdurchsatzmethoden für eine schnelle Proteinbestimmung innerhalb des durch die Dynamik der Embryoentwicklung gegebenen Zeitfensters. Hier kommen sämtliche Methoden im Bereich der Proteomics zum Einsatz.
Insgesamt sind an diesem Projekt folgende Institutionen beteiligt: Medical University Vienna, Austria (Project leader); Maylab Analytical Instruments, Austria; CELS, United Kingdom; Bay Zoltán Foundation for Applied Research, Hungary; Institute for Energy Problems of Chemical Physics, Russian Academy of Science.
Embryonen verschiedener Entwicklungsstufen mit morphologischen Auffälligkeiten, deren genaue physiologische Ursache noch ungeklärt ist.
Das Schwangerschaftshormon Progesteron wird vom Corpus Luteum synthetisiert und ist ein wesentliches Hormon für die Implantation und den Erhalt der Schwangerschaft. Es wird im Körper der Frau allerdings innerhalb kürzester Zeit von mehreren Progesteron umwandelnden Enzymen zu unterschiedlichen Progesteronmetaboliten umgebaut. Diese Metabolite des Progesterons sind bislang eher als Abfallprodukt gesehen worden, denn als biologisch aktive Substanz.
Eine Vielzahl neuerer Daten deutet allerdings darauf hin, dass einige dieser Metaboliten eine außerordentlich wichtige Funktion während der Zellproliferation und der Regulation von interzellulären Signalwegen haben können.
Wir wollen in diesem Projekt untersuchen, inwieweit Progesteronmetabolite einen Einfluss auf die Proliferation von Corpus Luteum-Zellen und die Hormonproduktion in vitro haben können. Wir erhoffen uns, Hinweise darauf zu erhalten, welche Rolle Progesteronmetaboliten im Rahmen einer Lutealphasenunterstützung während einer IVF-Therapie zukommt.