Wissenschaftliche Mitarbeiter:innen
Placental Development Group
| Martin Knöfler | Ao. Univ. Prof. Mag. Dr. | PI |
| Sandra Haider | Mag.a, PhD | PostDoc |
| Bianca Dietrich | MSc. | PhD Studentin |
| Gudrun Meinhardt | Mag.a, PhD | BMA |
| Leila Saleh | MSc. | BMA |
| Victoria Kunihs | MSc. | BMA |
| Theresa Maxian | MSc. | PhD Studentin |
Maternal Fetal Immunology Group (MFIG)
| Jürgen Pollheimer | Assoc. Prof. Mag. Dr. | PI |
| Anna-Lena Höbler | MSc. | PhD Studentin |
| Andreas Ian Lackner | MD, BSc. | PhD Student |
| Sigrid Vondra | MSc. MM.Sc. | PhD Studentin |
| Karin Windsperger | Mag.a Dr.in | PhD Studentin |
| Peter Haslinger | BSc. | BMA |
Wissenschaftlicher Schwerpunkt der Reproductive Biology Unit
Placental Development Group – PI Martin Knöfler
Seit mehr als 20 Jahren untersuchen wir biologische Funktionen, Differenzierung und Entwicklung der humanen Plazenta. Trotz der Tatsache, dass Fehler bei Implantation und früher Plazentaentwicklung zu vorzeitigem Abort oder Schwangerschaftserkrankungen wie Präeklampsie oder intrauteriner Wachstumsretardierung des Föten führen können, sind die molekularen Mechanismen der Plazentadifferenzierung unter physiologischen und pathologischen Bedingungen größtenteils unbekannt.
Über die Jahre studierte unser Team vorwiegend die Grundlagen der Plazentaentwicklung, wie transkriptionelle Kontrolle der Schwangerschaftshormone, Plazenta-spezifische Transkriptionsfaktoren sowie Signalwege, die die Invasion des Trophoblasten kontrollieren. Unsere Forschung führte zur Identifikation neuer Kontrollmechanismen, die an der trophoblastären Entwicklung und Differenzierung beteiligt sind wie z. B. Faktoren der Notch-, Wnt- und Hippo-Signalkaskaden.
Vor kurzem etablierten wir ein sich selbst organisierendes und erneuerndes humanes Plazenta-Organoid-System. Diese Plazenta-Organoide spiegeln die zelluläre Heterogenität innerhalb der Plazenta durch die spontane Bildung von synzytiotrophoblastären Zellschichten und die kontrollierte Bildung von invasiven, extravillösen Trophoblasten wider. Der Vorteil gegenüber 2D-Zellkultursystemen liegt in der Erhaltung der strukturellen Integrität und damit der räumlichen Ausrichtung der Zellen zueinander, wodurch neue Forschungsfelder eröffnet werden.
Aufgrund unserer kontinuierlichen Bemühungen und Weiterentwicklung unserer Gruppe wurde Martin Knöfler Editor des Top-Journals Placenta und Vorsitzender des Award Committee der International Federation of Placental Associations (IFPA). Außerdem gehört er zu den Top 50 der meistzitierten reproduktiven Biolog:innen aller deutschsprachigen Wissenschafter:innen.
Maternal Fetal Immunology Group – PI Jürgen Pollheimer
Die Etablierung der mütterlichen Toleranz gegenüber dem semiallogenen Feten in der Frühschwangerschaft stellt ein immunologisches Enigma dar. Ein Charakteristikum dieses Phänomens ist der kontrollierte Influx verschiedener Immunzelltypen in die Dezidua, in der mütterliche und fetale Zellen miteinander in Kontakt treten.
Um dieses Thema näher zu beleuchten, setzte Jürgen Pollheimer seinen Fokus auf immunologische Prozesse und zelluläre Interaktionen, die an der feto-maternalen Schnittstelle stattfinden. Zu seinen Forschungsthemen zählen die Charakterisierung von gewebsansässigen uterinen Macrophagen oder der Einfluss von hochendothelialen Venolen in der menschlichen Dezidua.
Seit 2018 ist Jürgen Pollheimer Mitglied des „Editorial Board“ des Top-Journals Placenta und wurde 2021 assoziierter Editor des Journals Molecular Human Reproduction.
Scopus: Sum of times cited: 2.846, h-index: 30
ORCID ID: 0000-0001-8440-5221
SCOPUS Author ID: 6507825565
Research Focus of the Reproductive Biology Unit
Placental Development Group – PI Martin Knöfler
For more than two decades our research focuses on the biological function, differentiation and development of the human placenta. Despite the fact that failures in implantation and early placental development result in pre-term abortions and pregnancy diseases such as preeclampsia or intra-uterine growth retardation of the fetus, little is known about the molecular mechanisms controlling placental differentiation under physiological and pathological conditions. Throughout the years our team predominantly investigated basic molecular mechanisms controlling regulation of placental hormones, placenta-specific transcription factors as well as signaling cascades controlling trophoblast invasion. Our research on these subjects resulted in the identification of novel mechanisms and genes involved in trophoblast differentiation such as factors of the Notch, Wnt-and Hippo signaling cascades.
Recently, we developed self-organizing and self-renewing human placenta-organoid systems. These placenta organoids reflect the cellular heterogeneity within the placenta, through the spontaneous formation of syncytiotrophoblastic layers and the controlled formation of invasive, extravillous trophoblasts. The advantage over conventional 2D cell culture systems lies in the preservation of the structural integrity and thus the spatial orientation of the cells to one another opening up new fields of investigations.
Due to our continuous efforts and development of our group Martin Knöfler became editor of the top journal “Placenta” and Chairman of the Award Committee of the International Federation of Placental Associations (IFPA). He is also amongst the TOP 50 most-cited Reproductive Biologists of all German-speaking scientists.
Maternal Fetal Immunology Group – PI Jürgen Pollheimer
The establishment of maternal tolerance to the semi-allogeneic fetus in early pregnancy is an immunological enigma. A characteristic of this phenomenon is the controlled influx of different immune cell types into the decidua, in which maternal and fetal cells come into contact. To shed light on this topic Jürgen Pollheimer has set his focus on immunological processes and cellular interactions taking place at the fetal maternal interface such as the characterization of tissue resident uterine macrophages or the impact of high endothelial venules in the human decidua.
Jürgen Pollheimer is Editorial Board Member of the top journal “Placenta” since 2018 and became Associate Editor of the journal “Molecular Human Reproduction” in 2021.
Scopus: Sum of times cited: 2.846, h-index: 30
ORCID ID: 0000-0001-8440-5221
SCOPUS Author ID: 6507825565
The two key steps of placental trophoblast differentiation
Within the placenta cytotrophoblasts of the placental villus undergo two different routes of differentiation (Figure 1). In floating villi embedded in maternal blood cytotrophoblasts fuse to form the multinucleated syncytium representing the barrier between fetal and maternal blood circulation. The syncytium also produces hormones such as placental lactogen and chorionic gonadotrophin which are essential for successful progression of pregnancy. Regulation of the latter has been intensively studied in our laboratory. We showed that cAMP-dependent factors as well as transcriptional activators of the AP-2 family are required for the differentiation-dependent expression of the two subunits of chorionic gonadotrophin, alpha and beta (Knöfler et al., 2000; Knöfler et al., 2004). Cytokines associated with pre-term labour and infection such as Tumor necrosis factor alpha (TNF-alpha) suppress chorionic gonadotrophin production and cell fusion (Leisser et al., 2006) suggesting that failed trophoblast differentiation could be associated with pregnancy diseases.
The second differentiation pathway of trophoblasts, invasive differentiation, represents another developmental process of the human placenta which is absolutely required for successful pregnancy outcome (Figure 1). In anchoring villi attaching to the uterine epithelium proliferative cell columns are formed giving rise to invasive extravillous trophoblasts. These cells invade the maternal uterine stroma as well as spiral arteries resulting in transformation of these uterine vessels. Apoptosis of smooth muscle cells as well as enlargement of vessel diameter finally ensure the appropriate blood flow to the growing placenta and fetus. Failures in this particular differentiation process were shown to be associated with gestational diseases such as preeclampsia and severe forms of fetal intra-uterine growth restriction. Details on the pathogenesis of the diseases, however, remain largely unknown.
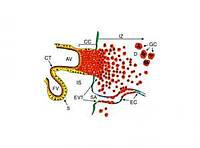
Fig. 1. Invasion of the placental trophoblast. Upon attachment of the placental anchoring villus (AV) to the uterine basement membrane, cyto-trophoblasts cells (CT) break through the multinuclear synzytium (S) which represents the transport unit of the floating villus (FV), and generate the proliferative cell column (CC). Upon growth arrest at the distal part of the CC the extravillous trophoblasts (EVT) are formed which invade into the underlying maternal decidua (D) and spiral arteries (SA) resulting in displacement of endothelial cells (EC) and establishment of blood flow into the intervillous space (IS). In deeper parts of the invasion zone (IZ) EVT form giant cells (GC) which represents another final stage of the differentiation process.
Throughout the years different trophoblast model systems including first trimester villous explant cultures, isolated primary trophoblasts and cell lines were established to investigate regulatory mechanisms controlling trophoblast invasion. Besides abundant growth factors expressed at the fetal-maternal interface trophoblast-derived chorionic gonadotrophin was found to regulate trophoblast migration and invasion (Saleh et al., 2007; Prast et al., 2008). The hormone was shown to stimulate matrix metalloproteinase 2 (MMP-2) expression through activation of ERK and AKT signalling. Another important signal transduction pathway involved in trophoblast invasion is the Wingless (Wnt) cascade. Human placenta and trophoblast express a variety of Wnt ligands and their receptors, members of the frizzled (fzd) family (Sondergger et al., 2007). Activation of Wnt signalling promoted trophoblast invasion and migration through the canonical pathway (Pollheimer et al., 2006). Recent collaborative approaches resulted in the identification of genes specifically expressed in villous or invasive, extravillous trophoblasts. One of those genes, heme oxygenase 1 was identified as a negative regulator of trophoblast motility (Bilban et al., 2008). Overexpression of the enzyme potentially suppresses trophoblast migration by increasing the transcription factor Peroxisome proliferator-activated receptor (PPAR) gamma which is known to inhibit trophoblast migration. Along those lines, we have also studied proteins such as TNF-alpha and endostatin which were shown to be increased in the serum of preeclamptic women (Hirtenlehner et al., 2003). TNF-alpha was shown to block trophoblast invasion and migration by increasing the protease inhibitor PAI-1 in different model systems (Bauer et al., 2004; Huber et al., 2006). This suggests that elevated pro-inflammatory cytokine expression at the fetal-maternal interface may contribute to the pathogenesis of preeclampsia by inhibiting invasive trophoblast differentiation. Similarly, endostatin which is also present in maternal decidua negatively affected in vitro trophoblast motility (Pollheimer et al., 2004; Pollheimer et al., 2005a).
Our findings with respect to transcription, trophoblast differentiation and signalling were summarised and combined with others data in several reviews (Knöfler et al., 2001; Loregger et al., 2003; Pollheimer et al., 2005b).
Novel routes of our laboratory involve functional studies of genes identified by differential gene expression profiling of non-invasive and invasive trophoblasts which potentially play a role in controlling trophoblast motility. Besides that, model systems of endometrial decidualisation and hormone-dependent lymphangiogenesis are currently being established in the laboratory.
References
Bauer S, Pollheimer J, Hartmann J, Husslein P, Aplin JD, Knöfler M. (2004)
Tumor necrosis factor-alpha inhibits trophoblast migration through elevation of plasminogen activator inhibitor-1 in first-trimester villous explant cultures. J Clin Endocrinol Metab, 89:812-822
Hirtenlehner, K, Pollheimer, J, Lichtenberger, C, Wolschek, MF, Zeisler, H, Husslein, P, Knöfler, M. (2003)
Elevated serum concentrations of the angiogenesis inhibitor endostatin in preeclamptic women. J Soc Gynecol Investig. 10:412-417
Huber AV, Saleh L, Bauer S, Husslein P, Knöfler M (2006)
TNF?-mediated Induction of PAI-1 Restricts Invasion of HTR-8/SVneo Trophoblast Cells. Placenta 27:127-136.
Knöfler, M., Saleh, L., Bauer, S., Vasicek, R., Griesinger, G., Strohmer, H., Helmer, H. and Husslein, P. (2000)
Promoter-Elements and Transcription Factors involved in Differentiation-dependent Human Chorionic Gonadotrophin-? mRNA Expression of Term Villous Trophoblasts. Endocrinology, 141: 3737-48
Knöfler M, Vasicek R, Schreiber M. (2001)
Key Regulatory Transcription Factors Involved in Placental Trophoblast Development-A Review. Placenta, 22:83-92
Knöfler M, Saleh L, Bauer S, Galos B, Rotheneder H, Husslein P, Helmer H. (2004)
Transcriptional Regulation of the Human Chorionic Gonadotrophin {beta} Gene during Villous Trophoblast Differentiation. Endocrinology, 145:1685-1694.
Leisser C, Saleh L, Haider S, Husslein H, Sonderegger S, Knöfler M. (2006)
Tumour necrosis factor-alpha impairs chorionic gonadotrophin beta-subunit expression and cell fusion of human villous cytotrophoblast. Mol Hum Reprod. 12:601-9.
Loregger, T., Pollheimer, J., and Knöfler, M. (2003)
Regulatory transcription factors controlling function and differentiation of human trophoblast-A review. Placenta 24, Supplement A, Trophoblast Research 17: 104-110
Pollheimer J, Bauer S, Huber A, Husslein P, Aplin JD, Knöfler M. (2004)
Expression pattern of collagen XVIII and its cleavage product, the angiogenesis inhibitor endostatin, at the fetal-maternal interface. Placenta 25:770-9
Pollheimer J, Husslein P, Knöfler M. (2005a)
Invasive trophoblasts generate regulatory collagen XVIII cleavage products. Placenta. 26: Suppl A:S42-5.
Pollheimer J, Husslein P, Knöfler M. (2005b)
Invasive trophoblasts generate regulatory collagen XVIII cleavage products. Placenta. 26: Suppl A:S42-5.
Pollheimer J, Loregger T, Sonderegger S, Saleh L, Bauer S, Bilban M, Czerwenka K, Husslein P, Knöfler M (2006)
Activation of the Canonical Wingless (Wnt) / T-cell factor (TCF) Signalling Pathway promotes Invasive Differentiation of Human Trophoblast. Am. J. Pathol., 168:1134-47.
Saleh L, Prast J, Haslinger P, Husslein P, Helmer H, Knöfler M. (2007)
Effects of Different Human Chorionic Gonadotrophin Preparations on Trophoblast Differentiation. Placenta 28:199-203
Sonderegger S, Husslein H, Leisser C, Knöfler M (2007)
Complex Expression Pattern of Wnt Ligands and Frizzled Receptors in Human Placenta and its Trophoblast Subtypes.
Placenta. 28 Suppl A:S97-S102.
Prast J, Saleh L, Husslein H, Sonderegger S, Helmer H, Knöfler M (2008)
Human chorionic gonadotrophin stimulates trophoblast invasion through ERK and AKT signalling. Endocrinology 149:979-87
Bilban M, Haslinger P, Prast J, Klinglmüller F, Woelfel T, Haider S, Sachs A, Otterbein LE, Desoye G, Hiden U, Wagner O, Knöfler M.
Identification of novel trophoblast invasion-related genes: Heme oxygenase-1 controls motility via PPAR{gamma} Endocrinology. 2008 Oct 9. [Epub ahead of print]
The role of AKT signalling in invasive trophoblast differentiation of the human placenta
In diesem von der Herzfelderschen Familienstiftung geförderten Projekt (APP00323OFF) untersuchten wir die Rolle von AKT Proteinen während der invasiven Trophoblastendifferenzierung.
Mitarbeiter: Haslinger P, Knöfler M.
Kurzbeschreibung:
AKT Proteine spielen eine wichtige Rolle bei Überlebensfähigkeit, Adhäsion und Migrationsverhalten von Zellen. Frühere Publikationen weisen darauf hin, dass Wachstumsfaktoren, die die Invasivität des Trophoblasten erhöhen, etwa EGF oder IGF-II, ihre Wirkung via Phosphorylierung und Aktivierung von AKT entfalten. Die Bedeutung der verschiedenen AKT Isoformen (AKT1,2,3) ist jedoch unklar. Es wurde die Expression der verschiedenen AKT Proteine in den unterschiedlichen Trophoblast-Modellsystemen festgelegt. Um die funktionelle Rolle der AKT Isoformen zu studieren, wurde mittels shRNA jeweils die Expression von AKT1,2,3 in Zellkultur ausgeschalten. Wir konnten zeigen, dass AKT1 und AKT3 entscheidend in der Trophoblastenmigration involviert sind, während AKT2 kein Funktion haben dürften. Proliferation und Apoptose waren in den einzelnen AKT-defizienten Klonen nicht verändert. Die Daten wurden in Biology of Reproduction publiziert (Haslinger et al., 2013).
Critical signalling pathways regulating trophoblast invasion of the human placenta
In diesem durch den Fonds zur Förderung der wissenschaftlichen Forschung unterstützten Projekt P22687-B13 untersuchen wir die Funktion verschiedener Mechanismen der Signaltransduktion, insbesondere die Rolle des Notch signalling in der invasiven Differenzierung des humanen Trophoblasten.
Mitarbeiter: Haider S, Otti G, Velicky P, Pollheimer J, Knöfler M.
Kurzbeschreibung:
Während der Schwangerschaft adhäriert die Plazenta an der mütterlichen Dezidua und bildet somit den extravillösen Trophoblasten (EVT). Dieser trophoblastäre Subtyp invadiert die Dezidua sowie Spiralarteriolen, um eine adäquate Nährstoffversorgung und die immunologische Akzeptanz in einem allogenen Umfeld zu gewährleisten. Die EVT Differenzierung ähnelt teilweise der Krebszellentstehung, unterscheidet sich aber durch strikte Kontrollmechanismen, deren Ursprung bisher noch nicht vollständig geklärt ist. Zum einen legen mehrere Studien eine Regulation der EVT Differenzierung über extrinsische Mechanismen nahe, andererseits gibt es die bemerkenswerte Beobachtung, dass die EVT Differenzierung auch ohne schwangerschafts-spezifische Umgebung stattfindet, wie zum Beispiel in differenzierenden in vitro Trophoblastenkulturen. In diesem Zusammenhang weisen unsere präliminären Daten darauf hin, dass bestimmte Mitglieder der ERBB Familie durch die Induktion eines konstitutiv aktiven Phänotypus die Funktion von EVT kontrollieren. Interessanterweise sind der ERBB2 Rezeptor und nukleäres ERBB4, zwei Induktoren der liganden-unabhängigen Signaltransduktion, stark in EVT exprimiert. Weitere in vitro Analysen zeigen eine reziproke Expression von zwei ERBB4 Varianten: einer differenzierungsfördernden Cyt-1 und einer proliferationsfördernden Cyt-2 Variante. Dieses Ergebnis spricht für eine varianten-spezifische Funktion von nukleärem ERBB4 während der EVT Differenzierung. Wir postulieren, dass ERBB2 als einziges ERBB Mitglied an der Membran von invasiven EVT zu finden ist. Diese Entdeckung stellt ein bis heute ausschließlich in Krebszellen beschriebenes Szenario dar, nämlich eine liganden-unabhängige ERBB2 Signaltransduktion. Zur Verfeinerung unserer deskriptiven Daten planen wir durchflusszytometrische Zellsortierungen von EVT Subtypen durchzuführen. Zusätzlich werden wir mittels verschiedener primärer Trophoblastenmodellsysteme die Rolle von ERBB2 und -4 während EVT-assoziierter Vorgänge wie Proliferation/Zellzyklusarrest, Akquisition eines invasiven Phänotypus und Migration/Invasion studieren. Erste funktionelle Analysen verweisen auf eine Rolle von ERBB2 in EVT, da ein betreffender „Knockdown“ zu Veränderungen in der EVT-spezifischen Morphologie und Unterdrückung der proinvasiven Differenzierung führt. Zusätzlich zu „loss-of-function“ Studien werden wir untergeordnete Effektoren von ERBB2 und -4 analysieren. Die Überexpression von ERBB2 ist ein weitverbreitetes Phänomen in der malignen Transformation. Aufgrund dessen planen wir eine Kohorte von trophoblastären Schwangerschaftserkrankungen mittels Immunhistochemie auf Expression, Bildung von Membran-assoziierter Dimere und Zellkompartimentsverteilung von ERBB Rezeptoren zu untersuchen. Zusammenfassend stellen wir mit der Theorie über liganden-unabhängige Prozesse in Trophoblasten ein neuartiges Konzept zur Klärung der EVT Differenzierung vor.
Expression von ERBB1 und ERBB2 in invasiven und nicht-invasiven Trophoblasten. A) Invasive Trophoblasten exprimieren kein ERBB1, überexprimieren jedoch ERBB2 und den ERBB1 Negativregulator Cbl-b. Die Expression von ITGA5, -6 und HLA-G1 ist dargestellt, um die Reinheit der jeweiligen Trophoblasten Pools zu verifizieren.
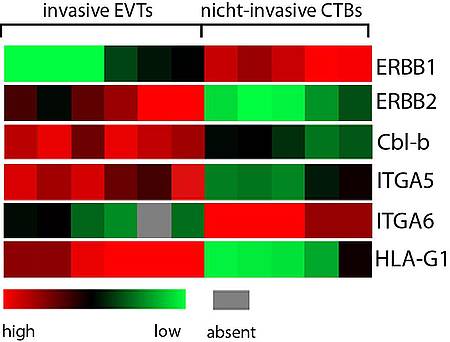
Expression von ERBB1 und ERBB2 in invasiven und nicht-invasiven Trophoblasten. A) Invasive Trophoblasten exprimieren kein ERBB1, überexprimieren jedoch ERBB2 und den ERBB1 Negativregulator Cbl-b. Die Expression von ITGA5, -6 und HLA-G1 ist dargestellt um die Reinheit der jeweiligen Trophoblasten Pools zu verifizieren.
Expression and function of IL-33/ST2 during trophoblast invasion
Dieses von der österreichischen Nationalbank unterstützte Projekt (Projektnummer: 13955) wurde mit Jänner 2013 abgeschlossen. Die Ergebnisse dieser Studie wurden im internationalen Topjournal „Journal of Immunology“ publiziert (Fock et al. 2013).
Mitarbeiter: Fock V, Zeisler H, Knöfler M, Pollheimer J
The role of ADAM-12 in normal and pathological pregnancies
Dieses von der österreichischen Nationalbank unterstützte Projekt (Projektnummer: 14147) wurde mit Ende 2013 abgeschlossen.
Mitarbeiter: Biadasiewicz K, Fock V, Knöfler M, Pollheimer J
Kurzbeschreibung:
ADAM-12 wird in zwei verschiedenen Varianten, durch alternatives Splicing, gebildet. ADAM-12L, die längere Form wird an der Zellmembran exprimiert und die kürzere Variante, ADAM-12S wird als solubles Protein sekretiert. Obwohl sehr wenig über die biologische Bedeutung dieser Protease bekannt ist, gibt es Hinweise, dass ADAM-12L in der Krebsentstehung und Metastasierung eine Rolle spielt. In einer erst kürzlich zur Begutachtung eingeschickten Publikation konnten wir zeigen, dass uteroplazentares ADAM-12 ausschließlich vom Trophoblasten gebildet wird. Des Weiteren konnten wir ADAM-12 als einen positiven Regulator der Trophoblasteninvasion identifizieren. Hierbei ist es uns gelungen, die ADAM-12 mediierte Aktivierung des pro-migratorischen Integrins beta 1 nachzuweisen. Darüber hinaus postulieren wir, dass ADAM-12 eine wichtige Rolle in der Degradation von IGFBP3 einnimmt und somit eine tragende Rolle in der Entstehung von Schwangerschaftserkrankungen spielen könnte.
Identification of factors controlling differentiation in human decidual stromal cells of early pregnancy
Mitarbeiter: Saleh L, Otti G, Knöfler M
Kurzbeschreibung:
Hormonabhängige Veränderungen der weiblichen Uterusschleimhaut (= Endometrium) stellen die Grundvoraussetzung für eine erfolgreiche Implantation und Schwangerschaft dar. In der ersten Zyklushälfte kommt es unter dem Einfluss von Östrogen, das vom Ovar sezerniert wird, zur Proliferation von Stromazellen und glandulären Epithelzellen des Endometriums, namensgebend für die proliferative Phase. Während nach dem Eisprung die Östrogenlevel rasch sinken, dominiert das luteale Hormon Progesteron, was die zweite Zyklushäfte oder sekretorische Phase einleitet. In dieser Phase wird ein Differenzierungsprozess in den endometrialen Zellen initiiert (= Prädezidualisierung), um das Endometrium für eine mögliche Nidation vorzubereiten. Kommt es zu keiner Befruchtung, atrophiert der Corpus luteum, die Progesteronspiegel sinken, was letztendlich zur Abstoßung der endometrialen Mucosa und zur Menses führt. Im Falle eine erfolgreichen Konzeption wird der Differenzierungsprozess des Endometriums, das ab diesem Zeitpunkt Dezidua genannt wird, vervollständigt und bis zum Ende der Schwangerschaft aufrechterhalten. Deziduale Faktoren kontrollieren z.B. Trophoblasteninvasion, schützen die Blastozyste vor oxidativem Stress und bieten ihr in der ersten Zeit eine Quelle für Nährstoffe. Die charakteristischste Veränderung während der Differenzierung ist die Transformation der spindeligen endometrialen Stromazellen in epitheloide Deziduazellen, die neben der morphologischen Wandlung auch ein einzigartiges Genexpessionsmuster zeigen. Die ausschlaggebenden Faktoren und Signalkaskaden, die zur stromalen Dezidualisierung führen, sind jedoch noch weitgehend unbekannt. Aus diesem Grund haben wir ein Zellkulturmodell etabliert, das uns erlaubt, den Differenzierungsprozess in vitro nachzuahmen (Saleh et al., 2011), und anhand dessen ausgewählte Signalwege, wie z.B. die Notch- und Wingless-Signalkaskade, erforscht werden können (Otti et al., 2014, in preparation).
Function of the Wingless ligand Wnt5A in placental differentiation and senescence
In diesem von der Herzfelderschen Familienstiftung unterstützen Projekt (AP00574OFF) untersuchen wir die Funktion des Wnt-Liganden Wnt5A während der Differenzierung und Seneszenz der Plazenta
Mitarbeiter: Meinhardt G, Knöfler M
Kurzbeschreibung
Die Wingless (Wnt)- Signalkaskade ist ein hochkonservierter Signalweg, der eine Rolle in der Zellproliferation und -differenzierung, Embryogenese und Onkogenese spielt. Der Wnt Ligand Wnt5A wurde kürzlich als Regulator des Wachstums und der Alterung von Ovarialkarzinoma-Zellen identifiziert und könnte diese Prozesse auch in anderen reproduktiven Zelltypen steuern. Tatsächlich haben wir und andere Wnt5A sowohl in der Plazenta als auch im schwangeren Endometrium, der Dezidua, nachgewiesen. Die Funktion des Liganden in diesem biologischen System ist jedoch noch unbekannt. Wir wollen daher mittels verschiedener molekularer Techniken und Trophoblastzell-Modellsystemen die Rolle von Wnt5A in der Plazentafunktion und Differenzierung studieren. Erste Experimente zeigten, dass der Ligand die Proliferation von primären Trophoblasten in vitro fördert. Sein möglicher Einfluss auf Apoptose und Invasion ist derzeit Thema unserer Forschungsarbeit.
Die Arbeitsgruppe soll eine Verbindung schaffen zwischen Grundlagenforschung, Klinik und Epidemiologie von Risikofaktoren, Ursachen und Eigenschaften des intrauterinen Fruchttodes. Zu den klinischen und wissenschaftlichen Schwerpunkten der Arbeitsgruppe zählen folgende Bereiche:
- Nationale/internationale Epidemiologie des intrauterinen Fruchttodes
- Retrospektive und prospektive Registererhebung des IUFT-Kollektivs an der Medizinischen Universität Wien
- Benennung der fetalen Todesursache gemäß internationaler Klassifikationssysteme (WHO-PM, Tulip, ReCoDe, etc.)
- Durchführung von post-mortem Untersuchungen (Genetik; Virtopsie; Obduktion; Plazentahistologie) und jährliche Audits
- Individualisierte Betreuung von Schwangeren mit Zustand nach IUFT an der MedUni Wien
- Psychologischer Einfluss auf Betroffene und medizinisches Personal
- Erhebung von Biomarkern
Die Arbeitsgruppe IUFT soll beitragen, die wenigen Fälle von intrauterinen Fruchttoden an der Medizinischen Universität Wien genauestens abzuklären, um einerseits den Eltern eine Antwort hinsichtlich der Ätiologie geben zu können und andererseits vermeidbare und unvermeidbare Risikofaktoren für Folgeschwangerschaften zu charakterisieren und rechtzeitig zu minimieren. Außerdem ist die Gruppe bestrebt, die Grundlagenforschung auf dem Gebiet der Plazentadysfunktion, die zu einem IUFT führen könnte, voranzutreiben und anhand von Biomarkern die Entwicklung prädiktiver Technologien zu unterstützen. Gemeinsam mit starken nationalen und internationalen Kollaborationen vertritt die Arbeitsgruppe das ultimative Ziel, der globalen intrauterinen Todesrate entgegenzuwirken und diese langfristig zu reduzieren.
Kooperationspartner an der Medizinischen Universität Wien
Universitätsklinik f. Frauenheilkunde:
Priv.-Dozin Dr.in Dana Muin, MMSc MRes
Dr.in Petra Pateisky
Univ.-Prof.in Dr.in Kinga Chalubinski
Dr.in Klara Rosta, PhD
Institut für Humangenetik:
Assoc.Prof. PD Dr. Jürgen Neesen
Plazentalabor:
Mag.a Dr.in Karin Windsperger
Assoc. Prof. Mag. Dr. Jürgen Pollheimer
Ao.Univ.-Prof. Mag. Dr. Martin Knöfler
Pathologie:
Dr.in Anke Scharrer
Radiologie:
Assoc. Prof. Dr. Gregor Kasprian
Dr. Gregor Dovjak
Dr.in Ivana Pogledic, PhD, EDiR
Labormedizin:
Priv.-Doz. Mag. DDr. Helmuth Haslacher, BSc BA
Kinder- und Jugendheilkunde, Klinische Psychosomatik:
Mag.a Dr.in Anna Felnhofer
Nationale Kooperationspartner
Medizinische Universität Graz, Institut für Humangenetik
Assoz. Prof.in Mag.a Dr.inrer.nat. Ellen Heitzer
ao.Univ.-Prof. Mag. Dr.rer.nat. Dr.scient.med. Erwin Petek
Geburtenregister Österreich, Institut für klinische Epidemiologie
DIin Sabrina Neururer, PhD
Mag. Hermann Leitner
Österreichische Gesellschaft für Gynäkologie und Geburtshilfe
Priv. Doz.in Dr.in Gunda Pristauz-Telsnigg, AOA (Präsidentin 2019–2022)
Fr. Stephanie Leutgeb

